Глюконеогене́з — метаболический путь, приводящий к образованию глюкозы из неуглеводных соединений (в частности, пирувата). Наряду с гликогенолизом, этот путь поддерживает в крови уровень глюкозы, необходимый для работы многих тканей и органов, в первую очередь, нервной ткани и эритроцитов. Он служит важным источником глюкозы в условиях недостаточного количества гликогена, например, после длительного голодания или тяжёлой физической работы [1] [2] . Глюконеогенез является обязательной частью цикла Кори, кроме того, этот процесс может быть использован для превращения пирувата, образованного при дезаминировании аминокислот аланина и серина [3] .
Суммарное уравнение глюконеогенеза выглядит следующим образом:
Глюконеогенез протекает в основном в печени, но менее интенсивно он протекает также в корковом веществе почек [en] и слизистой кишечника [2] .
Глюконеогенез и гликолиз регулируются реципрокно: если клетка снабжена энергией в достаточной степени, то гликолиз приостанавливается, и запускается глюконеогенез; напротив, при активизации гликолиза происходит приостановление глюконеогенеза [5] .
Глюконеогенез происходит у животных, растений, грибов и микроорганизмов. Его реакции одинаковы для всех тканей и биологических видов. Важными предшественниками глюкозы у животных выступают трёхуглеродные соединения, такие как лактат, пируват, глицерол, а также некоторые аминокислоты. У млекопитающих глюконеогенез происходит главным образом в печени, в меньшей степени — в корковом слое почек и эпителиальных клетках, выстилающих тонкую кишку. Образованная в ходе глюконеогенеза глюкоза уходит в кровь, откуда доставляется к другим тканям. После интенсивной физической работы лактат, образовавшийся при анаэробном гликолизе в скелетных мышцах, возвращается в печень и превращается там в глюкозу, которая снова поступает в мышцы или превращается в гликоген (этот круговорот известен как цикл Кори). У проростков растений запасённые в семени жиры и белки превращаются, в том числе и через глюконеогенез, в дисахарид сахарозу, который транспортируется по всему развивающемуся растению. Глюкоза и её производные служат предшественниками для синтеза растительной клеточной стенки, нуклеотидов, коферментов и многих других жизненно важных метаболитов. У многих микроорганизмов глюконеогенез начинается с простых органических соединений, содержащих два или три атома углерода, например, ацетата, лактата и пропионата, которые содержатся в питательной среде [1] .
Хотя реакции глюконеогенеза одинаковы у всех организмов, соседние метаболические пути и регуляторные пути глюконеогенеза отличаются у различных видов и в различных тканях [1] . В этой статье рассмотрены особенности глюконеогенеза млекопитающих; о механизмах синтеза глюкозы растениями из первичных продуктов фотосинтеза см. Фотосинтез.
Глюконеогенез и гликолиз не являются полностью идентичными процессами, протекающими в противоположных направлениях, хотя несколько стадий являются общими для обоих процессов: 7 из 10 ферментативных реакций глюконеогенеза обратны соответствующим реакциям гликолиза. Однако 3 реакции гликолиза необратимы in vivo и не могут использоваться в глюконеогенезе: образование глюкозо-6-фосфата из глюкозы под действием фермента гексокиназы, фосфорилирование фруктозо-6-фосфата до фруктозо-1,6-бифосфата фосфофруктокиназой-1 (PFK-1), а также превращение фосфоенолпирувата в пируват под действием пируваткиназы [en] . В клеточных условиях эти реакциии имеют большое отрицательное изменение энергии Гиббса, в то время как другие реакции гликолиза имеют ΔG около 0. При глюконеогенезе три необратимые стадии гликолиза заменены «обходными» реакциями, катализируемыми другими ферментами, и эти реакции также очень экзергоничны [en] и потому необратимы. Таким образом, в клетках как гликолиз, так и глюконеогенез являются необратимыми процессами. У животных гликолиз происходит только в цитозоле, как и большая часть реакций глюконеогенеза, хотя некоторые его реакции происходят в митохондриях и эндоплазматическом ретикулуме [6] . Это даёт возможность для их координированной и взаимно обратной регуляции. Регуляторные механизмы, различающиеся у гликолиза и глюконеогенеза, действуют на ферментативные реакции, уникальные для каждого процесса [1] .
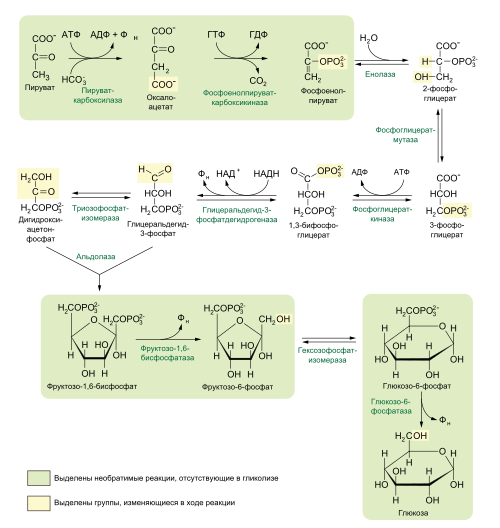
Ниже представлена схема реакций глюконеогенеза:
Ниже рассмотрены 3 стадии глюконеогенеза, отличные от реакций гликолиза, проведённых в обратном направлении.
Первой реакцией глюконеогенеза является превращение пирувата в фосфоенолпируват (ФЕП). Эта реакция не может быть обратной пируваткиназной реакции гликолиза, поскольку пируваткиназная реакция имеет большое отрицательное изменение энергии Гиббса и потому необратима в клеточных условиях. Вместо этого фосфорилирование пирувата осуществляется «окольным путём», для реакций которого у эукариот необходимы и цитозольные, и митохондриальные ферменты [8] .
Вначале пируват переносится из цитозоля в митохондрии или образуется в митохондриях из аланина путём трансаминирования, при котором α-аминогруппа переносится с аланина на α-кетокарбоновую кислоту. После этого митохондриальный фермент пируваткарбоксилаза [en] , для активности которой необходим кофермент биотин, превращает пируват в оксалоацетат:
Пируват + НСО3 — + ATP → оксалоацетат + ADP + Pi [9] .
В этой реакции карбоксилирования участвует биотин как переносчик активированного бикарбоната. HCO3 — фосфорилируется с затратой ATP с образованием смешанного ангидрида (карбоксифосфата). После этого на место фосфата в карбоксифосфате присоединяется биотин. Справа показан механизм этой реакции [7] .
Пируваткарбоксилаза является первым регулируемым ферментом глюконеогенеза, её позитивным эффектором служит ацетил-СоА (ацетил-СоА образуется при β-окислении [en] жирных кислот, и его накопление сигнализирует о доступности жирных кислот как энергетического ресурса). Кроме того, пируваткарбоксилазная реакция поставляет промежутоные соединения в другой центральный метаболический путь — цикл трикарбоновых кислот [7] .
Так как в митохондриальной мембране отсутствуют белки-переносчики оксалоацетата, до экспорта в цитозоль образовавшийся при пируваткарбоксилазной реакции оксалоацетат должен быть обратимо восстановлен в малат митохондриальным ферментом малатдегидрогеназой с затратой NADH:
Оксалоацетат + NADH + H + ⇌ L-малат + NAD + .
Стандартное изменение энергии Гиббса для этой реакции довольно велико, однако при физиологических условиях (среди которых и очень низкая концентрация оксалоацетата) её ΔG ≈ 0, поэтому эта реакция обратима. Митохондриальная малатдегидрогеназа участвует и в глюконеогенезе, и в цикле трикарбоновых кислот, осуществляя и прямую, и обратную реакции [10] . Оксалоацетат может также переноситься из митохондрии в цитозоль после трансаминирования в аспартат [6] .
Малат покидает митохондрию через специальный белок-транспортер на внутренней митохондриальной мембране [en] , и в цитозоле он вновь окисляется до оксалоацетата с образованием цитозольного NADH:
Малат + NAD + → оксалоацетат + NADH + H + [10] .
После этого оксалоацетат превращается в фосфоенолпируват под действием фосфоенолпируваткарбоксикиназы [en] . В этой Mg 2+ -зависимой реакции донором фосфорильной группы выступает GTP:
Оксалоацетат + GTP ↔ Фосфоенолпируват + СО 2 + GDP.
В клеточных условиях эта реакция обратима; образование фосфоенопирувата компенсируется гидролизом другого высокоэнергетичного фосфатсодержащего соединения — GTP [10] .
Общее уравнение для двух первых «обходных» реакций гидролиза выглядит следующим образом:
Пируват + ATP + GTP + HCO3 — → Фосфоенолпируват + ADP + GDP + Pi + CO2; ΔG’ o = 0,9 кДж/моль.
Два высокоэнергетичных фосфатных эквивалента (один от ATP и другой GTP), каждый из которых может дать 50 кДж/моль в клеточных условиях, затрачиваются для фосфорилирования одной молекулы пирувата с образованием фосфоенолпирувата. Однако в соответствующей реакции гликолиза (при образовании пирувата из ФЕП) образуется лишь одна молекула ATP из ADP. Хотя стандартное изменение энергии Гиббса ΔG’ o в двухшаговом превращении пирувата в фосфоенолпируват равно 0,9 кДж/моль, реальное изменение энергии Гиббса (ΔG), посчитанное с учётом внутриклеточных концентраций соединений, имеет большое отрицательное значение (—25 кДж/моль). Причиной этого является быстрое использование фосфоенолпирувата в других реакциях, так что его концентрация остаётся относительно низкой. По этой причине образование ФЕП из пирувата под действием глюконеогенетических ферментов в клеточных условиях необратимо [10] .
Стоит отметить, что тот же СО2, который присоединяется к пирувату в ходе пируваткарбоксилазной реакции, выделяется при фосфоенолпируваткарбоксикиназной реакции. Такое карбоксилирование-декарбоксилирование является путём «активации» пирувата, то есть декарбоксилирование оксалоацетата способствует образованию фосфоенолпирувата [10] .
Отношение [NADH]/[NAD + ] в цитозоле равно 8 × 10 4 , что примерно в 10 5 раз меньше, чем в митохондриях. Поскольку цитозольный NADH используется в глюконеогенезе (при образовании глицеральдегид-3-фосфата из 1,3-бифосфоглицерата), биосинтез глюкозы не может происходить, если нет доступного NADH. Транспорт малата из митохондрии в цитозоль и превращение его в оксалоацетат в цитозоле эффективно переносит восстановительные эквиваленты в цитозоль, где их недостаточно. Таким образом, такой путь от пирувата к ФЕП обеспечивает важный баланс между потребляемым и образуемым в цитозоле NADH в ходе глюконеогенеза [10] .
Выше отмечалось, что, кроме пирувата, предшественником для глюконеогенеза также может выступать лактат. Этот путь обеспечивает использование лактата, образовавшегося, например, при гликолизе в эритроцитах или в мышцах при анаэробных условиях. Особенно этот путь важен для крупных позвоночных после тяжёлой физической работы. Преобразование лактата в пируват в цитозоле гепатоцитов приводит к образованию NADH, поэтому в экспорте восстановительных эквивалентов (например, малата) из митохондрий здесь нет нужды. После того как пируват, образовавшийся в лактатдегидрогеназной реакции, транспортируется в митохондрии, он превращается в оксалоацетат под действием пируваткарбоксилазы, как писалось выше. Этот оксалоацетат, однако, превращается непосредственно в фосфоенолпируват митохондриальным изоферментом фосфоенолпируваткарбоксикиназой, а ФЕП выводится из митохондрий в цитозоль, где осуществляются дальнейшие реакции глюконеогенеза [11] .
У растений и некоторых бактерий было обнаружено два фермента, способных образовывать ФЕП непосредственно из пируватата. К их числу относится фосфоенолпируватсинтаза [en] бактерии Escherichia coli. При работе этого фермента его остаток гистидина связывает пирофосфатную группу, взятую от ATP. Далее пирофосфатная группа гидролизуется с выделением фосфата и образованием соединения фермент-His-P. Последний взаимодействует с пируватом, образуя ФЕП. Похожий механизм присущ пируват-фосфатдикиназе [en] , которая впервые было описана у тропических злаков и играет важную роль в С4-фотосинтезе [en] , а также задействована в глюконеогенезе у Acetobacter. Отличие этого фермента от фосфоенолпируватсинтазы заключается лишь в том, что атакующей частицей является не вода, а неорганический фосфат [12] .
Второй реакцией гликолиза, которая не может дублироваться обратной реакцией в глюконеогенезе, является фосфорилирование фруктозо-6-фосфата фосфофруктокиназой-1. Так как эта реакция высоко экзергонична и поэтому необратима в клеточных условиях, образование фруктозо-6-фосфата из фруктозо-1,6-бифосфата катализируется другим ферментом — Mg 2+ -зависимой фруктозо-1,6-бифосфатазой-1 [en] (FBPаза-1), которая катализирует необратимый гидролиз фосфата при первом атоме углерода (а не перенос фосфорильной группы на ADP):
Фруктозо-1,6-бифосфат + Н2О → фруктозо-6-фосфат + Pi, ΔG’ o = −16,3 кДж/моль [4] .
Кроме фруктозо-1,6-бифосфатазы-1 существует фруктозо-1,6-бифосфатаза-2, выполняющая регуляторные функции [4] .
Третья «обходная» реакция является последней реакцией глюконеогенеза: дефосфорилирование глюкозо-6-фосфата с образованием глюкозы. Если бы гексокиназа осуществляла эту обратную реакцию, то ей бы сопутствовал перенос фосфорильной группы с глюкозо-6-фосфата на ADP с образованием ATP, что энергетически невыгодно. Реакция, катализируемая глюкозо-6-фосфатазой, не включает синтеза ATP и представляет собой простой гидролиз фосфатного эфира:
Глюкозо-6-фосфат + Н2 → глюкоза + Pi, ΔG’ o = −13,8 кДж/моль [4] .
Этот Mg 2+ -зависимый фермент встречается на люменальной стороне эндоплазматического ретикулума гепатоцитов, в клетках почек и эпителиальных клетках тонкой кишки, однако в других тканях его нет, поэтому остальные ткани неспособны поставлять глюкозу в кровь. Если бы в них была глюкозо-6-фосфатаза, то она бы гидролизовала глюкозо-6-фосфат, который необходим этим тканям для гликолиза. Глюкоза, образовавшаяся в ходе глюконеогенеза в печени и почках или поглощённая с пищей разносится по кровотоку к этим тканям, в числе которых — мозг и мышцы [4] .
Суммарное уравнение биосинтетическиз реакций глюконеогенеза, приводящих к образованию глюкозы из пирувата, выглядит так:
2 Пируват + 4ATP + 2GTP + 2NADH + 2H + + 4H2O → глюкоза + 4ADP + 2GDP + 6Pi + 2NAD + .
На каждую молекулу глюкозы, образовавшуюся из пирувата, необходимо 6 высокоэнергетичных фосфатных групп, 4 из которых берутся от ATP и 2 — от GTP. Кроме того, для восстановления двух молекул 1,3-бифосфоглицерата необходимы 2 молекулы NADH. В то же время для гликолиза нужны лишь 2 молекулы ATP. По этой причине синтез глюкозы из пирувата является затратным процессом. Большая часть затрачиваемой энергии обеспечивает необратимость глюконеогенеза. В клеточных условиях суммарное изменение энергии Гиббса при гликолизе составляет −63 кДж/моль, а при глюконеогенезе — −16 кДж/моль. Таким образом, в клеточных условиях и гликолиз, и глюконеогенез необратимы [13] .
Описанный выше биосинтетический путь образования глюкозы относится к синтезу глюкозы не только из пирувата, но также 4-, 5- и 6-углеродных промежуточных соединений цикла трикарбоновых кислот. Цитрат, изоцитрат, α-кетоглутарат, сукцинил-СоА [en] , сукцинат, фумарат и малат — все промежуточные продукты цикла трикарбоновых кислот могут окисляться до оксалоацетата. Некоторые или все атомы углерода большей части аминокислот могут быть катаболизированы в пируват или промежуточные соединения цикла трикарбоновых кислот. Поэтому эти аминокислоты могут подвергнуться превращению в глюкозу и называются глюкогенными [en] . Аланин и глутамин — важнейшие молекулы, переносящие аминогруппы в печень из других тканей — служат особенно важными глюкогенными аминокислотами у млекопитающих. После того, как эти аминокислоты отдают свои аминогруппы в митохондриях печени, их углеродные скелеты (пируват и α-кетоглутарат соответственно) вовлекаются в глюконеогенез [14] . Аминокислоты образуются при распаде белков мышц и соединительной ткани, их включение в глюконеогенез происходит при продолжительном голодании или длительной физической нагрузке [2] .
У растений, дрожжей и многих бактерий имеется путь, позволяющий получать углеводы из жирных кислот — глиоксилатный цикл. У животных ключевых ферментов этого цикла нет, и, ввиду необратимости пируватдегидрогеназной реакции, они не могут получать пируват из ацетил-СоА, а значит, образовывать углеводы из жирных кислот (следовательно, и из липидов). Тем не менее, они могут использовать для глюконеогенеза те небольшие количества глицерола, который образуется при распаде жиров. При этом глицерол фосфорилируется глицеролкиназой [en] , далее следует окисление центрального атома углерода с образованием дигидроксиацетонфосфата, который является промежуточным соединением глюконеогенеза [14] .
Глицеролфосфат является необходимым промежуточным соединением при синтезе жиров (триглицеридов) в адипоцитах, однако эти клетки лишены глицеролкиназы и поэтому не могут осуществлять фосфорилирование глицерола. Вместо этого адипоциты могут осуществлять сокращённый вариант глюконеогенеза, известный как глицеронеогенез: преобразование пирувата в дигидроксиацетонфосфат через первые реакции глюконеогенеза, вслед за которым следует восстановление дигидроксиацетонфосфата до глицеролфосфата [14] .
Если бы гликолиз и глюконеогенез протекали бы одновременно и на большой скорости, то результатом стали бы расход ATP и образование тепла. Например, фосфофруктокиназа-1 и фруктозо-1,6-бифосфатаза-1 катализируют противоположные реакции:
ATP + фруктозо-6-фосфат → ADP + фруктозо-1,6-бифосфат (PFK-1) Фруктозо-1,6-бифосфат + H2O → фруктозо-6-фосфат + Pi (FBPаза-1).
Суммой этих двух реакций является
Эти две ферментативные реакции, как и ряд других реакций этих двух путей, регулируются аллостерически [en] и ковалентных модификаций. Гликолиз и глюконеогенез регулируются реципрокно, то есть если поток глюкозы, проходящей через гликолиз, растёт, то поток пирувата, проходящего через глюконеогенез, спадает, и наоборот [5] . Например, FBPаза-1 строго подавляется аллостерическим связыванием AMP, так что когда клеточные запасы ATP невелики, а уровень AMP высок, ATP-зависимый синтез глюкозы приостанавливается, а катализирующая соответствующую реакцию гликолиза PFK-1, наоборот, активируется AMP [15] . Хотя PFK-1 активируется фруктозо-2,6-бифосфатом [en] , на FBPазу-1 это соединение имеет противоположный эффект: он снижает его сродство к субстратам и тем самым замедляет глюконеогенез [16] .
По материалам wp.wiki-wiki.ru
Образование глюкозы из лактата. Лактат, образовавшийся в интенсивно работающих мышцах или в клетках с преобладающим анаэробным способом катаболизма глюкозы, поступает в кровь, а затем в печень. В печени отношение NADH/NAD + ниже, чем в сокращающейся мышце, поэтому лактатдегидрогеназная реакция протекает в обратном направлении, т.е. в сторону образования пирувата из лактата. Далее пируват включается в глюконеогенез, а образовавшаяся глюкоза поступает в кровь и поглощается скелетными мышцами. Эту последовательность событий называют «глюкозо-лактатным циклом», или «циклом Кори«.
Цикл Кори выполняет 2 важнейшие функции: 1 — обеспечивает утилизацию лактата; 2 — предотвращает накопление лактата и, как следствие этого, опасное снижение рН (лактоацидоз). Часть пирувата, образованного из лактата, окисляется печенью до СО2 и Н2О. Энергия окисления может использоваться для синтеза АТФ, необходимого для реакций глюконеогенеза.
Образование глюкозы из аминокислот. Аминокислоты, которые при катаболизме превращаются в пируват или метаболиты цитратного цикла, могут рассматриваться как потенциальные предшественники глюкозы и гликогена и носят название гликогенных. Например, окса-лоацетат, образующийся из аспарагиновой кислоты, является промежуточным продуктом как цитратногр цикла, так и глюконеогенеза. Из всех аминокислот, поступающих в печень, примерно 30% приходится на долю аланина. Это объясняется тем, что при расщеплении мышечных белков образуются аминокислоты, многие из которых превращаются сразу в пируват или сначала в оксалоацетат, а затем в пируват. Последний превращается в аланин, приобретая аминогруппу от других аминокислот. Аланин из мышц переносится кровью в печень, где снова преобразуется в пируват, который частично окисляется и частично включается в глюкозонеогенез. Следовательно, существует следующая последовательность событий (глюкозо-аланиновый цикл): глюкоза в мышцах → пируват в мышцах → аланин в мышцах → аланин в печени → глюкоза в печени → глюкоза в мышцах. Весь цикл не приводит к увеличению количества глюкозы в мышцах, но он решает проблемы транспорта аминного азота из мышц в печень и предотвращает лактоацидоз.
Образование глюкозы из глицерола. Глицерол образуется при гидролизе триацил-глицеролов, главным образом в жировой ткани. Использовать его могут только те ткани, в которых имеется фермент глицерол киназа, например печень, почки. Этот АТФ-зависимый фермент катализирует превращение глицерола в α-глицерофосфат (глицерол-3-фосфат). При включении глицерол-3-фосфата в глюконеогенез происходит его дегидрирование NAD-зависимой дегидрогеназой с образованием дигидроксиацетонфосфата, который далее превращается в глюкозу.
35.35 Представление о пентозофосфатном пути превращений глюкозы. Окислительные реакции (до стадии рибулозо-5-фосфата). Распространение и суммарные результаты этого пути (образование пентоз, НАДФН и энергетика)
Пентозофосфатный путь, называемый также гексомонофосфатным шунтом, служит альтернативным путём окисления глюкозо-6-фосфата. Пентозофосфатный путь состоит из 2 фаз (частей) — окислительной и неокислительной.
В окислительной фазе глюкозо-6-фосфат необратимо окисляется в пентозу — рибулозо-5-фосфат, и образуется восстановленный NADPH. В неокислительной фазе рибулозо-5-фосфат обратимо превращается в рибозо-5-фосфат и метаболиты гликолиза. Пентозофосфатный путь обеспечивает клетки рибозой для синтеза пуриновых и пиримидиновых нуклеотидов и гидрированным коферментом NADPH, который используется в восстановительных процессах. Суммарное уравнение пентозофосфатного пути выражается следующим образом:
3 Глюкозо-6-фосфат + 6 NADP + → 3 СО2 + 6 (NADPH + Н + ) + 2 Фруктозо-6-фосфат + Глицеральдегид- 3 -фосфат.
Ферменты пентозофосфатного пути, так же, как и ферменты гликолиза, локализованы в цитозоле. Наиболее активно пентозофосфатный путь протекает в жировой ткани, печени, коре надпочечников, эритроцитах, молочной железе в период лактации, семенниках.
В окислительной части пентозофосфатного путиглюкозо-6-фосфат подвергается окислительному декарбоксилированию, в результате которого образуются пентозы. Этот этап включает 2 реакции дегидрирования.
Первая реакция дегидрирования — превращение глюкозо-6-фосфата в глюконолактон-6-фосфат — катализируется NАDР + -зависимой глюкозо-6-фосфатдегидрогеназой и сопровождается окислением альдегидной группы у первого атома углерода и образованием одной молекулы восстановленного кофермента NADPH. Далее глюконолактон-6-фосфат быстро превращается в 6-фосфоглюконат при участии фермента глюконолактонгидратазы. Фермент 6-фосфоглюконатдегидрогеназа катализирует вторую реакцию дегидрирования окислительной части, в ходе которой происходит также и декарбоксилирование. При этом углеродная цепь укорачивается на один атом углерода, образуется рибулозо-5-фосфат и вторая молекула гидрированного NADPH. Восстановленный NADPH ингибирует первый фермент окислительного этапа пентозофосфатного пути — глюкозо-6-фосфатдегидрогеназу. Превращение NADPH в окисленное состояние NADP + приводит к ослаблению ингибирования фермента. При этом скорость соответствующей реакции возрастает, и образуется большее количество NADPH.
Суммарное уравнение окислительного этапа пентозофосфатногопути можно представить в виде:
Реакции окислительного этапа служат основным источником NADPH в клетках. Гидрированные коферменты снабжают водородом биосинтетические процессы, окислительно-восстановительные реакции, включающие защиту клеток от активных форм кислорода.
Окислительный этап образования пентоз и неокислительный этап (путь возвращения пентоз в гексозы) составляют вместе циклический процесс. Такой процесс можно описать общим уравнением:
Это означает, что из 6 молекул глюкозы образуются 6 молекул рибулозо-5-фосфат (пентозы) и 6 молекул СО2. Ферменты неокислительнойфазы превращают 6 молекул рибулозо-5-фосфат в 5 молекул глюкозы (гексозы). При последовательном проведении этих реакций единственным полезным продуктом является NADPH, образующийся в окислительной фазе пентозофосфатного пути. Такой процесс называют пентозофосфатным циклом. Протекание пентозофосфатного цикла позволяет клеткам продуцировать NADPH, необходимый для синтеза жиров, не накапливая пентозы.
Энергия, выделяющаяся при распаде глюкозы, трансформируется в энергию высокоэнергетического донора водорода — NADPH. Гидрированный NADPH служит источником водорода для восстановительных синтезов, а энергия NADPH преобразуется и сохраняется во вновь синтезированных веществах, например жирных кислотах, высвобождается при их катаболизме и используется клетками.
По материалам studfiles.net
Глюконеогенез – синтез глюкозы из веществ неуглеводной природы, протекающий в основном в печени, и, менее интенсивно, – в корковом веществе почек и слизистой оболочке кишечника.
Функция глюконеогенеза – поддержание уровня глюкозы в крови при длительном голодании и интенсивных физических нагрузках. Постоянное поступление глюкозы в качестве источника энергии особенно необходимо для нервной ткани и эритроцитов.
Субстраты глюконеогенеза – ПВК, молочная кислота, глицерин, аминокислоты. Их включение в глюконеогенез зависит от физиологического состояния организма.
Большинство реакций глюконеогенеза являются обратными гликолизу. Они катализируются теми же ферментами, что и соответствующие реакции гликолиза.
Три реакции гликолиза (гексокиназная (1), фосфофруктокиназная (3), пируваткиназная (10)) необратимы, и при глюконеогенезе на этих этапах работают другие ферменты.
Синтез глюкозы из ПВК.
1-ый этап – образование фосфоенолпирувата из ПВК.
а) карбоксилирование ПВК под влиянием пируваткарбоксилазы с образованием оксалоацетата в митохондрии:
Пируваткарбоксилаза – митохондриальный фермент, аллостерическим активатором которого является ацетил-KоА. Для оксалоацетата мембрана митохондрий непроницаема, поэтому оксалоацетат в митохондриях превращается в малатпри участии митохондриальной НАД-зависимой малатдегидрогеназы:
Малат выходит из митохондрии через митохондриальную мембрану в цитозоль, где под действием цитоплазматической НАД-зависимой малатдегидрогеназы окисляется в оксалоацетат:
б) в цитозоле клетки протекает декарбоксилирование и фосфорилирование оксалоацетата с образованием фосфоенолпирувата; фермент – фосфоенолпируваткарбоксикиназа:
2-ой этап – превращение фруктозо-1,6-бисфосфата во фруктозо-6-фосфат.
Фосфоенолпируват в результате обратимых реакций гликолиза превращается во фруктозо-1,6-фосфат. Далее следует необратимая фосфофруктокиназная реакция гликолиза. Глюконеогенез идёт в обход этой реакции:
3-ий этап – образование глюкозы из фруктозо-6-фосфата.
Фруктозо-6-фосфат превращается в глюкозо-6-фосфат, который дефосфолирируется (реакция идёт в обход гексокиназной) под влиянием глюкозо-6-фосфатазы:
95.83.20.14 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
По материалам studopedia.ru
Глюконеогенез — это процесс синтеза глюкозы из веществ неуглеводной природы. У млекопитающих эту функцию выполняет в основном печень, в меньшей мере — почки и клетки слизистой кишечника. Главными субстратами глюконеогенеза являютсяпируват, лактат, глицерин, аминокислоты (рис.10).
Глюконеогенез обеспечивает потребности организма в глюкозе в тех случаях, когда диета содержит недостаточное количество углеводов (физическая нагрузка, голодание). Постоянное поступление глюкозы особенно необходимо для нервной системы и эритроцитов. При понижении концентрации глюкозы в крови ниже определенного критического уровня нарушается функционирование мозга; при тяжелой гипогликемии возникает коматозное состояние и может наступить летальный исход.
Запасов гликогена в организме достаточно для удовлетворения потребностей в глюкозе в период между приемами пищи. При углеводном или полном голодании, а также в условиях длительной физической работы концентрация глюкозы в крови поддерживается за счет глюконеогенеза. В этот процесс могут быть вовлечены вещества, которые способны превратиться в пируват или любой другой метаболит глюконеогенеза. На рисунке показаны пункты включения первичных субстратов в глюконеогенез:
Глюкоза необходима для жировой ткани как источник глицерола, входящего в состав глицеридов; она играет существенную роль в поддержании эффективных концентраций метаболитов цикла лимонной кислоты во многих тканях. Даже в условиях, когда большая часть потребностей организма в калориях обеспечивается за счет жира, всегда сохраняется определенная потребность в глюкозе. Кроме того, глюкоза служит единственным видом топлива для работы скелетной мышцы в анаэробных условиях. Она является предшественником молочного сахара (лактозы) в молочных железах и активно потребляется плодом в период развития. Механизм глюконеогенеза используется для удаления из крови продуктов тканевого метаболизма, например лактата, образующегося в мышцах и эритроцитах, глицерола, непрерывно образующегося в жировой ткани
Включение различных субстратов в глюконеогенез зависит от физиологического состояния организма. Лактат является продуктом анаэробного гликолиза в эритроцитах и работающих мышцах. Глицерин высвобождается при гидролизе жиров в жировой ткани в постабсорбтивный период или при физической нагрузке. Аминокислоты образуются в результате распада мышечных белков.
Семь реакций гликолиза легко обратимы и используются в глюконеогенезе. Но три киназные реакции необратимы и должны шунтироваться (рис. 12). Так, фруктозо-1,6-дифосфат и глюкозо-6-фосфат дефосфорилируются специфическими фосфатазами, а пируват фосфорилируется до образования фосфоенолпирувата посредством двух промежуточных стадий через оксалоацетат. Образование оксалоацетата катализируется пируваткарбоксилазой. Этот фермент содержит в качестве кофермента биотин. Оксалоацетат образуется в митохондриях, транспортируется в цитозоль и включается в глюконеогенез. Следует обратить внимание на то, что каждая из необратимых реакций гликолиза вместе с соответствующей ей необратимой реакцией глюконеогенеза составляют цикл, называемый субстратным:
Таких циклов существует три — соответственно трем необратимым реакциям. Эти циклы служат точками приложения регуляторных механизмов, в результате чего изменяется поток метаболитов либо по пути распада глюкозы, либо по пути ее синтеза.
Направление реакцийпервого субстратного цикла регулируется главным образом концентрацией глюкозы. При пищеварении концентрация глюкозы в крови повышается. Активность глюкокиназы в этих условиях максимальна. Вследствие этого ускоряется гликолитическая реакцияглюкоза ® глюкозо-6-фосфат. Кроме того, инсулин индуцирует синтез глюкокиназы и ускоряет тем самым фосфорилирование глюкозы. Поскольку глюкокиназа печени не ингибируется глюкозо-6-фосфатом (в отличие от гексокиназы мышц), то основная часть глюкозо-6-фосфата направляется по гликолитическому пути.
Превращение глюкозо-6-фосфата в глюкозу катализируется другой специфической фосфатазой—глюкозо-6-фосфатазой. Она присутствует в печени и почках, но отсутствует в мышцах и жировой ткани. Наличие этого фермента позволяет ткани поставлять глюкозу в кровь.
Распад гликогена с образованием глюкозо-1-фосфата осуществляется фосфорилазой. Синтез гликогена идет по совершенно другому пути, через образование уридиндифосфатглюкозы, и катализируетсягликогенсинтазой.
Второй субстратный цикл: превращение фруктозо-1,6-бисфосфата во фруктозо-6-фосфат, катализируется специфическим ферментомфруктозо-1,6-бисфосфатазой. Этот фермент имеется в печени и почках, он был также обнаружен в поперечнополосатых мышцах.
Направление реакцийвторого субстратного цикла зависит от активности фосфофруктокиназы и фосфатазы фруктозо-1,6-бисфосфата. Активность этих ферментов зависит от концентрации фруктозо-2,6-бисфосфата.
Фруктозо-2,6-бисфосфат образуется путем фосфорилирования фруктозо-6-фосфата при участии бифункционального фермента (БИФ), который катализирует также и обратную реакцию.
Киназная активность проявляется, когда бифункциональный фермент находится в дефосфорилированной форме (БИФ-ОН). Дефосфорилированная форма БИФ характерна для абсорбтивного периода, когда инсулин-глюкагоновый индекс высокий.
При низком инсулин-глюкагоновом индексе, характерном для периода длительного голодания, происходят фосфорилирование БИФ и проявление его фосфатазной активности, результатом чего являются снижение количества фруктозо-2,6-бисфосфата, замедление гликолиза и переключение на глюконеогенез.
Киназная и фосфатазная реакции катализируются разными активными центрами БИФ, но в каждом из двух состояний фермента — фосфорилиро-ванном и дефосфорилированном — один из активных центров ингибирован.
Дата добавления: 2015-09-18 ; просмотров: 1264 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
По материалам helpiks.org